前言
靶向蛋白质降解(TPD)是一种新兴的治疗方法,因其在治疗上可以调节传统小分子难以靶向的蛋白质而备受关注。蛋白降解靶向嵌合体(PROTAC)是利用细胞内天然的蛋白降解体系——泛素蛋白酶系统(UPS)实现目标蛋白(POI)的靶向降解。PROTAC是异双功能的小分子,其一端靶向POI,一端招募E3泛素连接酶形成哑铃型结构的三元复合物,POI被打上泛素标签,进而被蛋白酶体识别降解。
自从首次报道了利用泛素-蛋白酶体系统降解靶蛋白的PROTAC分子概念以来的20年里,TPD已经从学术界转移到工业界,许多公司已经启动了临床前和早期临床开发的计划。2019年,第一批PROTAC分子进入临床试验;2020年,针对雌激素受体(ER)和雄激素受体(AR)癌症靶点的PROTAC临床概念得到证明。有了这一成功,目前,TPD领域现在已经准备好并致力于攻克那些被认为“不可治疗”的靶点。
PROTAC概述
PROTAC的概念最早是在2001年由Crews等人提出,能够利用机体内天然存在的蛋白清理系统,降低蛋白水平而非抑制蛋白的功能,发挥治疗疾病的目的。泛素依赖性蛋白水解是降解细胞内蛋白质的主要途径,是正常细胞维持生理过程的一部分。在该途径中,蛋白质被蛋白酶体以三步过程降解,包括泛素激活酶(E1)、泛素结合酶(E2)和泛素-蛋白质连接酶(E3),它们协调泛素分子向目标蛋白质(底物)的转移。
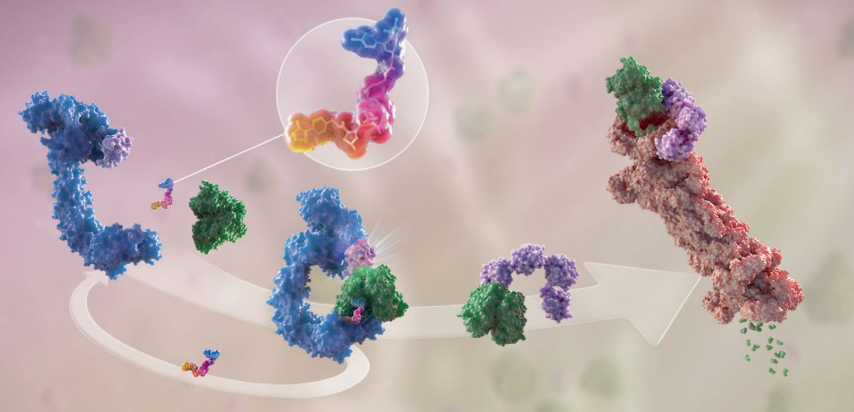
PROTAC是一种异双功能分子,可以分为三个部分:第一部分连接结合靶蛋白的配体,第二部分连接E3连接酶的配体,中间有一个连接体把第一部分和第二部分连在一起。它的作用机理非常简单,就是首先把目标蛋白和E3连接酶连在一起。这个三元复合物形成以后,泛素酶就会自动转移到目标蛋白上,然后蛋白酶体通过识别目标蛋白上的泛素酶来靶向降解目标蛋白。
PROTAC的优点
第一,PROTAC分子有催化降解功能。与每一个小分子抑制剂只能作用一个蛋白分子不同,每个PROTAC分子可以降解很多个蛋白分子,所以很低的剂量就可以有很好的药效。而且只要细胞内还存有少量的PROTAC分子,药效就可以得以保持。
第二,传统的小分子和抗体的作用模式需要抑制剂或单抗具备较高的浓度才能够占据靶点的活性位点,阻断下游信号通路的转导。而PROTAC不是影响蛋白的功能,而是介导致病靶蛋白被降解。不需要作用于蛋白的活性位点以抑制其活性,只需与靶蛋白有一定的结合率就可以,所以可以选择的靶蛋白结合体会多一些,有可能作用于一些传统意义上的不可成药的靶点。
第三,因为PROTAC通过降解目标蛋白起作用,当小分子的耐药性是因为细胞合成了更多的靶蛋白引起的情况下,PROTAC可以克服此类小分子药物耐药性的问题。总而言之, PROTAC技术结合了小分子化药,大分子生物药物以及RNAi分子的优点,有可能成为产生下一批重磅药物的关键技术。
PROTAC的发展
PROTAC的第一个时代始于Sakamoto等人于2001年发表的关键性PROTAC论文,这是第一次证明了PROTAC的体外概念验证。Protac-1被设计用于靶向甲硫酰氨基肽酶2(METAP2),这是抑制血管生成的有效靶点。Protac-1由两个结构域组成:ovalicin以及来自核因子-κB抑制剂-α(NF-κBIα)的10个氨基酸的磷酸肽,其被E3连接酶β-转导子重复序列(β-TRCP)识别。Protac-1充当METAP2和β-TRCP之间的纽带,使连接酶能够泛素化METAP2。
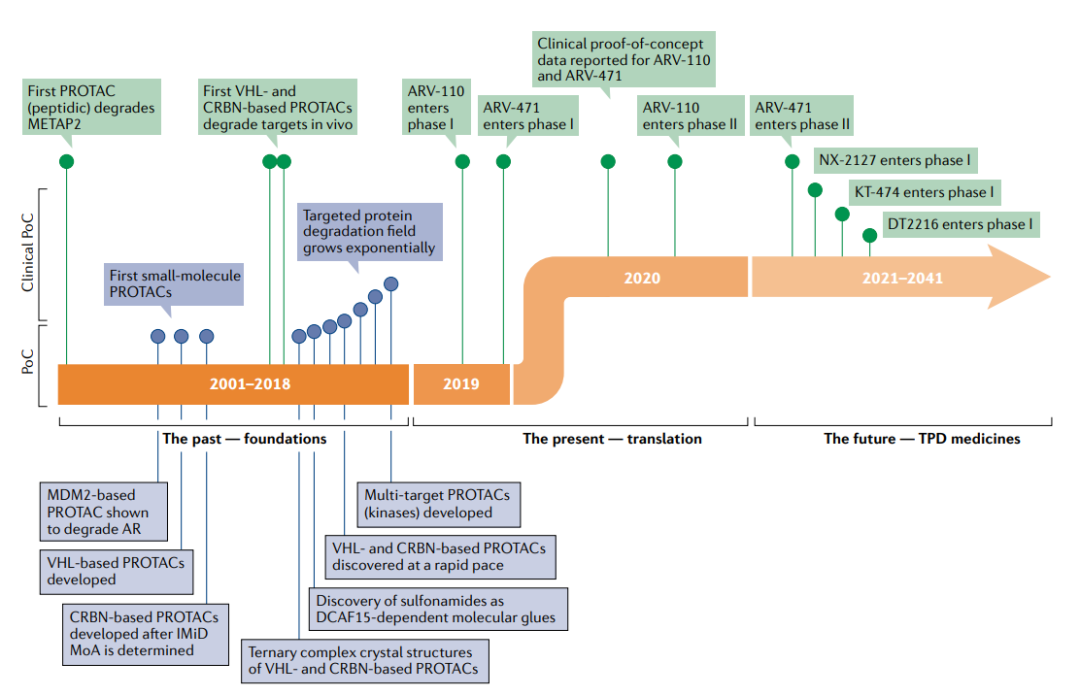
随后人们发现了一种来自缺氧诱导因子1亚单位-α(HIF1α)的肽,该肽结合vonHippel–Lindau(VHL)E3连接酶,从而设计出可降解一系列POI的细胞穿透性PROTAC。从技术上讲,这些早期的PROTAC现在被认为是“生物PROTAC”,因为它们不是完全的小分子结构,而是包含了E3连接酶的肽配体。然而,HIF1α肽的小分子模拟物的发现为完全基于小分子结构的PROTAC的设计打开了大门。从这时起,PROTAC这一领域的分子开发呈指数级增长。
2019年第一个进入临床试验的PROTAC药物ARV-110终结了TPD的这一基础时代,ARV-110通过将雄激素受体招募到CRL4–CRBN连接酶复合物中来靶向雄激素受体。从这时起,PROTAC进入了临床转化时代,在此阶段,设计用于降解致病蛋白质的多个分子进入临床,这一领域变得无比火热。
PROTAC的临床验证
在PROTAC进入临床之前,人们依然存在着多种疑问。它们会有药物一样的特性吗?它们在人类身上安全吗?它们会像预期的那样对目标蛋白起作用吗?它们会有治疗效果吗?令人鼓舞的是,2020年,ARV-110和ARV-471的第一阶段临床试验的初步阳性数据对所有四个基本问题的回答都是肯定的。


