美国FDA批准了55款新药,获批数量在过去30年中仅次于2018年的59款。同样中国国家药监局(NMPA)也批准了37 个1类新药(不包括新增适应症、疫苗、诊断试剂),较2022年(22个)大幅上涨68%。
从药物类型来看,包括化药21个,生物药11个,中药5个。
表1. 2023年NMPA批准上市的1类新药
抗肿瘤药占据半壁江山
中药1类新药亮眼
从适应症来看,抗肿瘤和免疫促进药占比最多(46%),其次为抗感染、消化系统、糖尿病及糖尿病相关疾病等领域治疗药物。
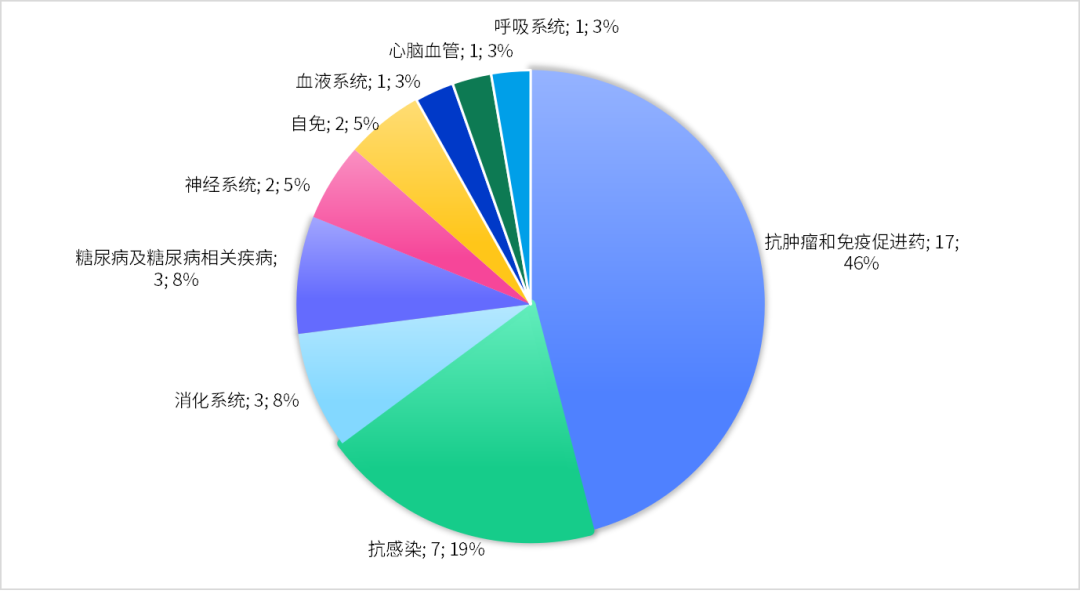
如果剔除中药和新冠病毒感染治疗药物,抗肿瘤药(15个)和免疫促进药(2个)占比为63%。具体癌种来看,肺癌占绝大多数,有6款用于非小细胞肺癌的小分子靶向疗法,1款用于小细胞肺癌的PD-L1免疫疗法。
肺癌是全球癌症死亡的主要原因。肺癌分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌患者占比约为80%。得益于肺癌基因组测序取得的突破,发现了各类致癌突变,如EGFR、ALK、ROS1、MET、BRAF等。基于此,全球各大药企开发了一代又一代的肺癌靶向治疗药物,国内药企也在不断努力,近几年开发出来多款国产靶向药。
2023年,NMPA获批了6个非小细胞肺癌靶向治疗药物,分别国产新药伯瑞替尼、舒沃替尼、伊鲁阿克片、贝福替尼、谷美替尼和进口新药莫博赛替尼。
除了靶向药,免疫疗法作为后起之秀,2023年NMPA又批准了2个PD-L1/PD-1单抗、2个CAR-T细胞疗法,分别为恒瑞医药的PD-L1单抗阿得贝利单抗、李氏大药厂的PD-1单抗索卡佐利单抗、驯鹿生物的BCMA CAR-T疗法伊基奥仑赛、合源生物的CD19 CAR-T疗法纳基奥仑赛。
随着疫情进入新的阶段,2023年NMPA附条件批准了4个国产小分子新冠病毒治疗药物,包括先声药业的先诺特韦片/利托那韦片组合包装、君实生物的氢溴酸氘瑞米德韦片、众生药业的来瑞特韦片和广生中霖生物的阿泰特韦片/利托那韦片组合包装。
在中药方面,2023年国家先后出台了一系列政策法规促进中医药传承、创新与发展,中医药产业发展迈入新时代。
2023年,NMPA批准了5个中药1类新药,分别为思济药业/一力制药的参郁宁神片、以岭药业的通络明目胶囊、健民药业的小儿紫贝宣肺糖浆、青峰药业的枳实总黄酮片、合一生技的香雷糖足膏。
恒瑞医药成最大赢家
多个企业斩获首个新药
从企业来看,恒瑞是最大赢家。2023上半年,恒瑞医药有3个创新药在国内获批,包括自研创新药2个:磷酸瑞格列汀片、阿得贝利单抗注射液,引进创新药1个:奥特康唑胶囊。至此,恒瑞医药获批上市的自研创新药达13款、合作引进创新药达两款。
贝达药业也有2个创新药获得批准,分别为肾细胞癌新药伏罗尼布片和非小细胞肺癌新药甲磺酸贝福替尼胶囊。
信达生物也有2个创新药获得批准,分别为PCSK9单抗托莱西单抗,用于治疗原发性高胆固醇血症和混合型血脂异常,以及与驯鹿生物合作的BCMA CAR-T疗法伊基奥仑赛,用于治疗多发性骨髓瘤。
除了头部创新药企,多个生物技术公司囊获首个上市的1类新药,例如柯菲平医药、海和药物、博锐生物、驯鹿生物、迪哲医药、合源生物等。
小 结
近年来,在特别审批、突破性治疗药物、附条件批准、优先审评审批等药品加快上市注册程序下,国内外新药快速进入中国市场。
但是与FDA批准的新药略有不同,NMPA批准的化药和生物药适应症主要集中在肿瘤,而且靶点创新程度有限。而FDA批准的新药适应症以罕见病、罕见肿瘤为主,在药物类型上多肽、小核酸等新型疗法快速发展。这与国内外市场环境差异、创新药发展历程长短有关。目前而言,国外市场更鼓励去探索一些更新的靶点和适应症,对于比较新的靶点,药企也偏向于出海去寻找机会。总之,中国创新药还有很长的路要走。


