2024年5月至6月期间美国食品药品监督管理局(FDA)对已批准上市的BTK抑制剂类药物说明书中肝脏毒性相关信息进行更新,警示BTK抑制剂类药物诱导性肝损伤。
【背景情况】
2022年7月至2023年11月间,FDA因BTK 抑制剂类药物诱导的肝损伤部分暂停(partial clinical hold)BTK 抑制剂类药物在多发性硬化症(MS)和自身免疫性疾病受试者中开展的临床试验,包括:(1)暂停新受试者招募;(2)用药时间<60天或者<70天的受试者中止用药。上述BTK 抑制剂类药物包括:奥布替尼,Tolebrutinib,Evobrutinib和Fenebrutinib。
2023年,FDA官网同时发布了2023年1月至3月期间FDA不良事件报告系统(FAERS)中识别的潜在安全性信号列表,包括所有四个已批准在美国上市的BTK抑制剂类药物的新的、潜在的安全性信号,即药物诱导的肝损伤。
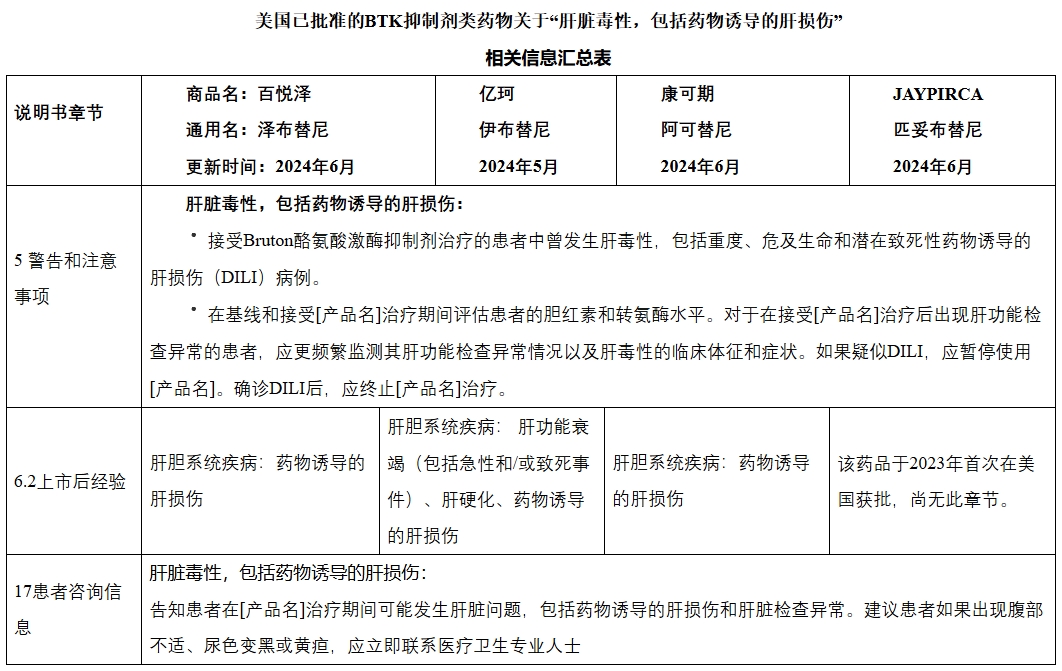
FDA历时一年多对BTK抑制剂类药物导致的肝损伤进行了综合评价,目前FDA要求所有已批准在美国上市的BTK抑制剂类药物(包括以下四个:泽布替尼(百悦泽),伊布替尼(亿珂),阿可替尼(康可期),匹妥布替尼(JAYPIRCA))修订美国说明书增加肝脏毒性相关描述。
FDA于官网发布了已批准的BTK抑制剂类药物关于“肝脏毒性,包括药物诱导的肝损伤”相关信息,BTK抑制剂类药物安全性问题相关说明书变更的信息汇总见下表: